1 引言
脑电(electroencephalogram, EEG)及其衍生技术——事件相关电位(event-related potentials, ERPs)在神经科学、心理学等领域应用广泛,被誉为“脑功能的窗口”。EEG具有毫秒量级的时间分辨率,能及时捕捉到大脑自发神经或认知诱发活动的动态变化,分离不同的认知加工过程,但其空间分辨率较低。与之对比的是功能磁共振(functional magnetic resonance imaging, fMRI),其空间分辨率达毫米量级,能通过磁共振造影测量大脑血氧活动间接推测出脑功能活动,但其时间分辨率较低。结合两种技术的优势,有望实现对脑功能活动高时空分辨率的观测,这就是同步脑电-功能磁共振(EEG-fMRI)。该技术可同步采集大脑功能活动的电生理和血氧代谢信号,是全方位观测大脑的强有力手段,为痫样放电的定位、认知神经动态过程的描述等提供了无创的、全脑覆盖的观测手段。
同步EEG-fMRI具有显著优越性,但在数据采集和分析过程中也存在很大的技术难点,比如两种模态数据采集的相互干扰,被试在采集过程中的舒适性差,数据融合方法纷繁复杂等。基于这些难点,本文在介绍同步EEG-fMRI硬件系统的基础上,将从EEG伪迹去除、基于EEG信息的fMRI分析、同步EEG-fMRI的应用、未来研究前景四个方面综述该领域的最新信号处理进展,期望为此新技术在国内的推广和应用提供重要参考。
2 同步EEG-fMRI系统简介
fMRI成像需要借助高强磁场,但射频激发会使磁场的梯度迅速变化。同步EEG-fMRI需采用能在高强磁场中运行的磁协EEG系统,该系统能在保证EEG和fMRI信号采集质量的同时,保障被试的安全和在射频线圈内佩戴脑电采集系统的舒适性。
同步EEG-fMRI系统通常采用图1的导线连接方式:通过带式电缆将EEG电极帽的连接盒与磁谐放大器相连。磁谐放大器采用电池或兼容核磁环境的可充电电源供电。经过放大的EEG信号则通过光纤传输到扫描室外的光电转换器,光电转换器同时接收来自同步盒的梯度转换时钟信息。同步盒是将磁共振的扫描时间和EEG的数值化转换时间进行匹配的装置,能有效提高梯度伪迹去除的效果。通过对比采用同步盒与否的EEG信号,我们发现采用同步盒会使梯度伪迹在每层扫描中更加一致,有助于离线EEG数据处理时梯度噪声的去除。同步盒通过一个叫同步盒-扫描仪接口的装置,和MRI总控机组相连。最后,经数字化后的EEG信号通过USB连线传输到计算机中,同步扫描的fMRI图像则通过磁共振系统独立输出。
同步EEG-fMRI实验首先需要做好设备部件的选择和调试工作,优化连线减少回路,最大程度的提高数据质量。为降低电阻,提高敏感性,EEG电极通常采用银/氯化银(Ag/AgCI)、金制塑料等材料,导线采用绝缘的光纤材料[1],并按照梯度变换最大的方向布线以减少伪迹[2]。此外,可以在被试的头部放置真空垫来增加舒适度,降低头动的影响[3]。带式电缆需要平行排列,材质通常为极细的铜材料或碳纤维,长度尽量减小,一般不超过1.5 m。为消除梯度伪迹,磁谐放大器需采用1000 Hz以上的采样率,并将其放置于fMRI扫描腔末端的磁场屏蔽盒中,以减小导线长度。磁谐电极帽通常采用单极导联,以Fcz为参考电极,离线分析采用平均参考或连接耳参考。
3 同步EEG-fMRI伪迹去除
3.1 fMRI影像伪迹去除
同步进行磁共振和脑电数据采集,设备之间会互相干扰。同步EEG-fMRI伪迹主要来源于MRI对EEG信号的干扰,但EEG记录也会对fMRI图像质量造成影响[4]。电极的材质会影响fMRI成像的质量,导致电极附近区域MRI信号的丢失。磁共振兼容EEG电极需选择碳纤维或者银/氯化银等无磁性金属材料。脑电放大器的电磁噪声会导致磁共振图像存在格纹状伪迹,可以使用电池或蓄电池供电,并将放大器置于遮蔽盒内。除了硬件因素,被试自身的行为也会导致fMRI伪迹。比如长时间的采集会让被试感到不适,增大头动。主试需要在实验前和被试做好解释沟通,增强被试实验参与的积极性和配合度。需要尽量缩短实验时间,使用耳塞减少磁共振运行噪声的影响。在数据离线分析阶段,可通过影像处理软件去除轻微头动的影响,如平移量小于1 mm的影像伪迹。
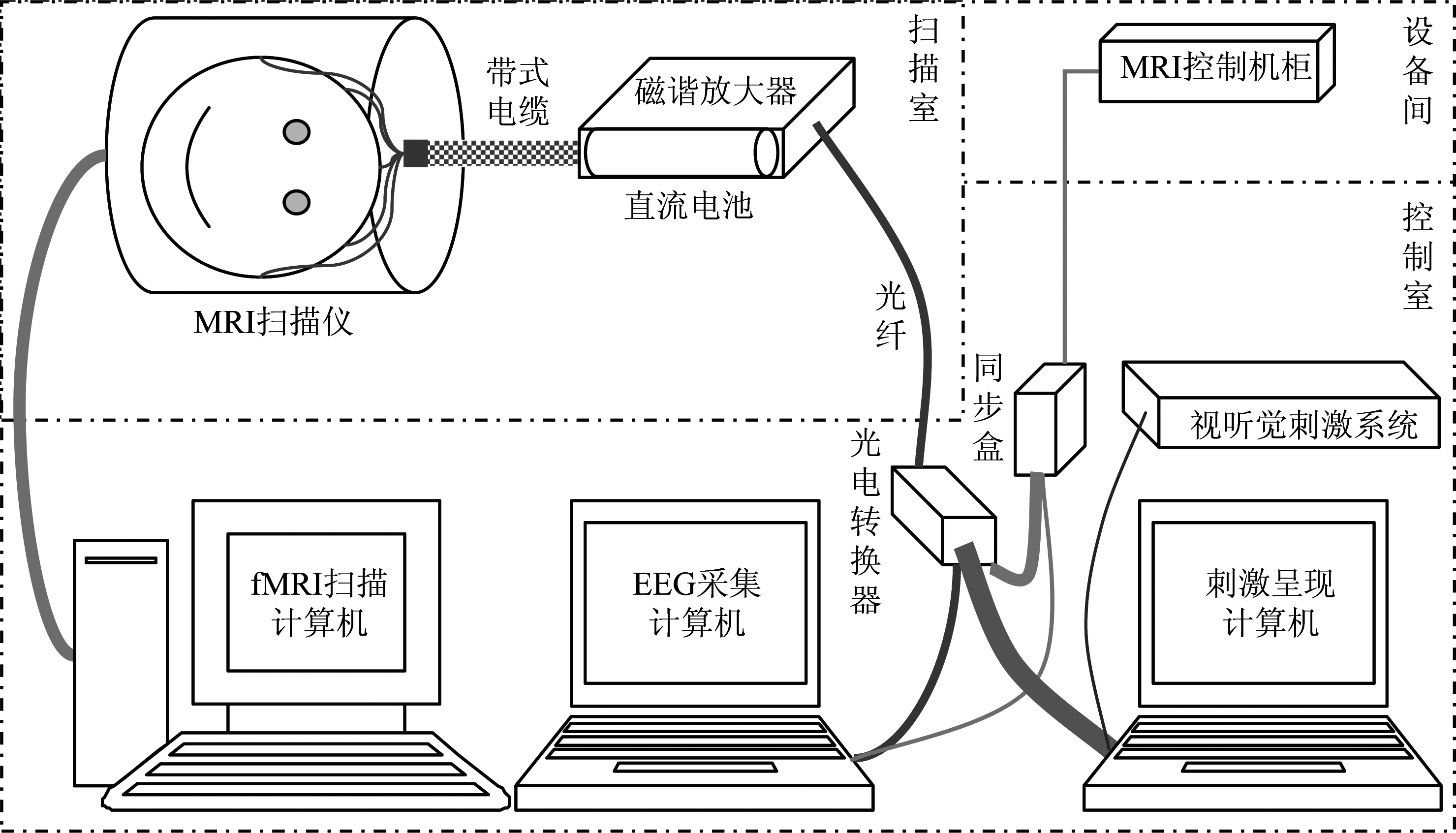
图1 同步EEG-fMRI系统的结构简图
Fig.1 The schematic of the simultaneous EEG-fMRI system
3.2 EEG伪迹去除
EEG伪迹去除是同步EEG-fMRI技术面临的最大挑战,这就使伪迹去除成为之后开展所有同步信号处理的前提。在磁共振扫描腔同步进行脑电记录时,主要产生以下三种伪迹:(1)射频脉冲导致的EEG信号。这类伪迹的频率与EEG信号的频率在兆赫范围的分布差异很大,可以采用低通滤波器消除;(2)梯度伪迹,是由梯度磁场快速切换引起的,具有模式固定性,其典型幅值是EEG幅度的100~1000倍。该伪迹因与EEG频率部分重合,增加了其去除难度;(3)心电伪迹,是在MRI环境下由主动脉弓处血流冲击及心跳引起的伪迹[5]。此外,MRI环境诱发的伪迹源还包括头动、氦冷却泵、扫描仪通风系统和灯光等。
近年来,得益于信号处理技术的快速发展,同步EEG-fMRI伪迹去除方法大量涌现。以Pubmed数据库为例,以“EEG-fMRI”和“artifact”为关键词进行搜索,能找到161篇研究涉及该领域。特别是2008年后,平均每年都有10篇以上的伪迹去除相关的论文发表出来。总体来说,这些伪迹去除技术可分为三类:(1)伪迹模板时域相减法。该技术具有原理简单,计算量小的特点:首先需要构造伪迹模板,从脑电信号中减去此模板,然后去除伪迹。(2)盲源分离法。一般采用独立成分分析、主成分分析等,将EEG原始信号分离成不同的独立成分,识别出伪迹成分然后去除。(3)硬件法。采用碳纤索套等专业的硬件设备,直接测量伪迹的波形,然后从受污染的EEG信号中减去这些伪迹。由于梯度伪迹和心电伪迹是同步EEG信号噪声的主要来源,下文我们主要介绍这两种伪迹的去除方法,如表1所示,目前已经发展出十多种不同的伪迹剔除方法。
表1 EEG伪迹去除方法
Tab.1 EEG artifact correction methods
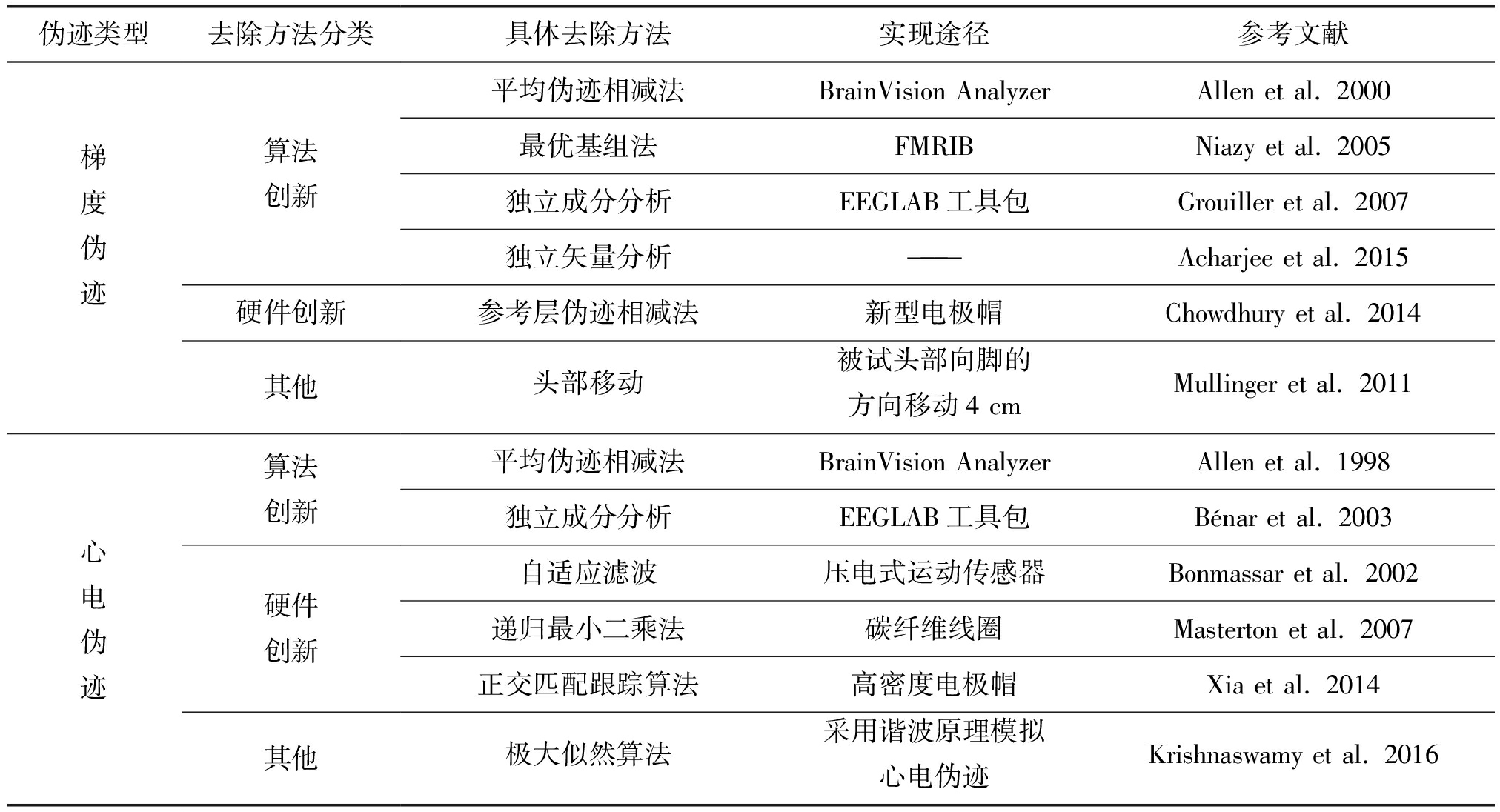
伪迹类型去除方法分类具体去除方法实现途径参考文献梯度伪迹算法创新硬件创新其他平均伪迹相减法BrainVision AnalyzerAllen et al. 2000最优基组法FMRIBNiazy et al. 2005独立成分分析EEGLAB工具包Grouiller et al. 2007独立矢量分析———Acharjee et al. 2015参考层伪迹相减法新型电极帽Chowdhury et al. 2014头部移动被试头部向脚的方向移动4 cmMullinger et al. 2011心电伪迹算法创新硬件创新其他平均伪迹相减法BrainVision AnalyzerAllen et al. 1998独立成分分析EEGLAB工具包Bénar et al. 2003自适应滤波压电式运动传感器Bonmassar et al. 2002递归最小二乘法碳纤维线圈Masterton et al. 2007正交匹配跟踪算法高密度电极帽Xia et al. 2014极大似然算法采用谐波原理模拟心电伪迹Krishnaswamy et al. 2016
3.2.1 梯度伪迹
梯度伪迹是同步脑电信号中幅度最大的噪声,目前已有多种成熟的算法可用于该伪迹的去除,大多还有配套的商业或开源软件:(1)平均伪迹相减法,也叫图像伪迹去除法(image artifact reduction, IAR),首先需要提取每个时间点上的梯度伪迹,然后进行多次叠加平均,构造出伪迹模板,再从原始信号中减去该模板,这样可以去除大部分梯度伪迹,残留的伪迹则采用自适应抵消法去除[6]。商业软件BrainVision Analyzer (Brain Products, Germany)等采用了这一算法。(2)最优基组法(Optimal Basis Sets, OBS)[7],由Niazy等在IAR的基础上提出。由于梯度伪迹通常和MRI的扫描序列存在相关,会在EEG采集中反复有规律的出现。首先对原始EEG信号进行插值,确定梯度扫描开始的准确时间。然后根据扫描开始的时间,分别提取梯度磁场切换时诱发的梯度伪迹,通过多次叠加平均构造噪声模板。模板的构造采用自适应的方式(即对于每段EEG,其伪迹模板都是由其附近约30个伪迹段构造),再通过相减的方法在EEG信号中减去噪声模板。对伪迹模板减除后的残留噪声,使用主成分分析的方法找到噪声相关成分并去除。此方法可通过EEGLAB工具包中FMRIB插件实现。(3)独立成分分析。该技术通常用于识别EEG的肌电或眼电伪迹成分,也可以用于梯度伪迹的成分识别。通过计算每个独立成分和伪迹模板的相关系数,找出和梯度伪迹最相关的成分并去除[8]。此方法可通过EEGLAB工具包实现。(4)独立矢量分析(independent vector analysis, IVA),一种扩展了的独立成分分析(independent component analysis, ICA)技术:每个成分由三维以上的矢量构成[9]。该方法根据fMRI的全脑扫描时间,对EEG数据进行分段,每个分段都是对伪迹的一次多维度观测,同时具有空间-时间-频率信息。这些信息被用于矢量分解,使得梯度伪迹从原始信号中分离出来。还可进一步考虑伪迹波形的电极空间依赖性,通过这种依赖关系来估计特定导联的伪迹。独立矢量分析充分利用了EEG的时间、空间和频率信息,基于伪迹源估计,可实现梯度伪迹的精准去除。
目前,在梯度伪迹去除的硬件开发方面,也取得了较大进步。Chowdhury等最近发明了一种新型电极帽,专门用于采集同步EEG-fMRI数据。该电极帽包括两层电极:参考电极层和标准电极层,标准电极层置于参考层之下并直接和头皮接触,可以采集到含有伪迹和神经电生理信号的混合信号;而参考层电极和头皮隔开,只能采集到磁共振相关伪迹,例如梯度伪迹、心电伪迹和运动伪迹等。之后,通过将标准电极和参考电极获得的信号进行比对,可以分离出无核磁伪迹的EEG信号。这种硬件去除方法的算法基础是“参考层伪迹相减法”[10]。此外,有研究发现如果将被试的头部向脚的方位移动4 cm,能在保证fMRI图像质量的同时减少40%的EEG伪迹[11]。总之,已有的梯度伪迹去除方法表现尚佳:平均伪迹相减法具有速度快,能在线进行伪迹去除等优势,而最优基组法恢复的EEG信噪比更高,伪迹更少。相对来说,独立成分分析效果并不稳定,而硬件设备也具有操作复杂,准备时间长的问题。未来研究需同时结合硬件设计和算法创新,开发出适应多种fMRI扫描序列的梯度伪迹去除方法。
3.2.2 心电伪迹
相对于梯度伪迹,心电伪迹的去除要更难一些。目前,主要有两种去除方法:(1)平均伪迹相减法,通过借助同步记录的心电波形来获得每次心电伪迹出现的时间,然后平均各导的心电信号得到心电伪迹模板,最后再从原始信号中减去此模板[12]。目前,研究者多采取模式识别算法,来提取心电伪迹出现的时间[9]。商业软件BrainVision Analyzer使用了这一算法。(2)ICA,通过ICA方法将原始EEG信号分解为多个成分,然后根据每个成分的时间进程识别出与心电伪迹相关的成分,最后从原始信号中减去此成分[3]。此方法可通过EEGLAB工具包实现。Vanderperren等通过对比分析,发现基于平均伪迹相减的方法和基于ICA的方法有相似的性能,但心电伪迹相关的成分选取复杂,基于平均伪迹相减法的方法具有更高的稳健性和实用性。
除了上述基于软件的方法外,不少研究者发展出了基于硬件的伪迹测量方法[13]。Bonmassar等研制了压电式运动传感器用于监测同步EEG-fMRI记录时产生的心电、头动等相关伪迹,然后从原始信号中剔除,其算法基础是“自适应滤波”[14]。Masterton等提出一种实时去伪迹技术,研究者让被试头戴有碳纤维线圈的帽子,用于记录心电、运动伪迹,然后采用线性自适应技术和递归最小二乘算法达到实时伪迹滤除[15]。Xia等通过从高密度商业电极帽中有选择性的选取一些电极专门用来记录心电,并用绝缘层和头皮隔开,最后采用正交匹配跟踪算法从原始信号中去除心电伪迹[16]。为了避免额外的硬件设备使同步EEG-fMRI设备变得更加复杂,Krishnaswamy等采用谐波原理模拟心电伪迹,将心电伪迹去除问题当作局部谐波回归分析处理,最后采用极大似然算法估算并去除心电伪迹[17]。目前,心电伪迹的去除仍是同步EEG-fMRI伪迹处理中的难题。根据我们实验室目前收集的大量同步EEG数据来看,亟待开发适应不同心电信号质量、不同头动规律的心电伪迹去除方法。
4 基于EEG信息的fMRI分析
目前,同步EEG-fMRI的融合研究总体可以分为两类:对称融合和不对称融合。对称融合,是通过建立共同的生成模型或利用交互信息来解释两种模态的数据。不对称融合方法主要是利用其中一种模态的信息来指导另一种模态的分析,对模态有所偏倚,其中最具影响力的不对称融合方法包括:(1)时间预测,即基于EEG信息的fMRI分析:用特定的EEG特征卷积上血氧动力学响应函数后对fMRI的波形进行建模;(2)空间约束,即基于fMRI约束的EEG成像:用从fMRI获得的空间活动信息来约束EEG的源重建[18-20]。其中又以基于EEG信息的fMRI分析最为常用。
基于EEG信息的fMRI分析采用EEG特征作为预测变量,对fMRI时间过程进行建模。由于该技术是同步EEG-fMRI信号融合中最为常用和成熟的分析方法,下面我们重点介绍这一领域的研究进展。通常的步骤为:基于神经血管的线性耦合假设,EEG中提取到的神经活动特征在卷积血氧动力学响应函数后,构成了预测的功能磁共振信号,然后在全脑的功能磁共振信号中找出相关的神经活动激活区域[21]。总结以往的研究,如表2所示,我们根据研究者基于EEG信号的不同指标与fMRI数据进行融合的目的,并按照按脑电导联数由少到多、头表覆盖由部分到全脑、时间精度由秒到毫秒、难度由简单到复杂,将基于EEG信息的fMRI分析相关研究总结归纳为以下四类。
表2 基于EEG信息的fMRI分析归纳总结
Tab.2 The classification of EEG-Informed fMRI analysis
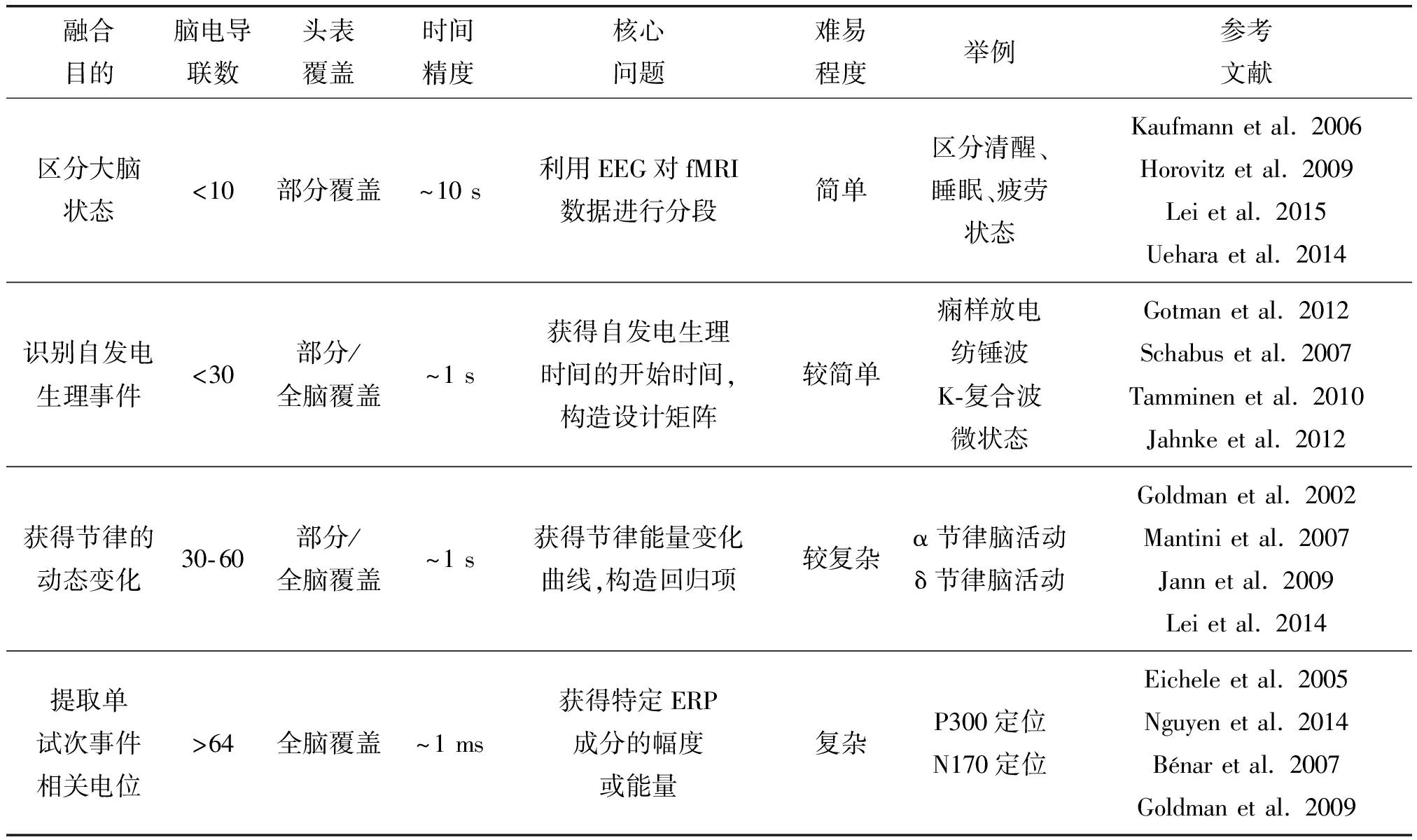
融合目的脑电导联数头表覆盖时间精度核心问题难易程度举例参考文献区分大脑状态<10部分覆盖~10 s利用EEG对fMRI数据进行分段简单区分清醒、睡眠、疲劳状态Kaufmann et al. 2006Horovitz et al. 2009Lei et al. 2015Uehara et al. 2014识别自发电生理事件<30部分/全脑覆盖~1 s获得自发电生理时间的开始时间,构造设计矩阵较简单痫样放电纺锤波K-复合波微状态Gotman et al. 2012Schabus et al. 2007Tamminen et al. 2010Jahnke et al. 2012获得节律的动态变化30-60部分/全脑覆盖~1 s获得节律能量变化曲线,构造回归项较复杂α节律脑活动δ节律脑活动Goldman et al. 2002Mantini et al. 2007Jann et al. 2009Lei et al. 2014提取单试次事件相关电位>64全脑覆盖~1 ms获得特定ERP成分的幅度或能量复杂P300定位N170定位Eichele et al. 2005Nguyen et al. 2014Bénar et al. 2007Goldman et al. 2009
4.1 区分大脑状态
从清醒到睡眠的各个阶段中,EEG信号会呈现不同的变化模式,可以利用EEG信号分离出不同的觉醒状态,然后对相应阶段的fMRI数据进行功能网络分析。采用多导睡眠仪(polysomnography, PSG)或EEG,可以将睡眠划分为清醒(W期)、非快速眼动睡眠期(non-rapid eye movements, NREM)和快速眼动睡眠期(rapid eye movements, REM),其中NREM可根据入睡深度进一步分为N1期、N2期、N3期。每个睡眠期主要根据其特征波形、眼电和下颏肌电活动进行综合判定。基于EEG数据的睡眠分期,就可以对比不同睡眠阶段功能磁共振信号活动的差异。Kaufmann等探究了从清醒到NREM睡眠不同阶段局部功能磁共振信号的变化,结果发现相较于清醒期,NREM睡眠各阶段总体表现为大量脑区功能磁共振信号活动下降,包括大脑皮层、丘脑、边缘叶、尾状核等,具体表现为:相对于W期,N1期表现为额叶、边缘结构、枕叶和脑岛等区域活动的降低;N2期表现为额叶、边缘结构、颞叶、右侧脑岛等活动的进一步降低。N3期脑区活动降到最低水平,涉及到额叶、边缘叶、颞叶、枕叶和脑岛等脑区。这表明随着睡眠的逐步深入,大脑活动降低的脑区逐渐增多,有利于深度睡眠的形成和维持[22]。Horovitz等进一步探讨了慢波睡眠阶段默认模式网络(default-mode network, DMN)的空间分布,发现在慢波睡眠期DMN存在前额叶区域丢失的现象,这表明DMN在意识觉知中发挥着重要作用[23]。除了上述从激活和大尺度脑网络角度分析fMRI数据以外,Lei等分析了清醒和NREM阶段的大脑无标度特性[24],Uehara等采用“图论分析”探讨了W期和N1期的“小世界网络”属性[25]。由于MRI的射频脉冲和读取梯度磁场等的频率范围和肌电、眼电的频率范围重叠较大,导致目前REM期判别仍有困难,探讨REM相关的fMRI活动规律仍有一定难度。
4.2 识别自发电生理事件
EEG可以用来刻画内源性警觉状态的变化过程,识别包括痫样放电、纺锤波、K复合波等自发性神经电活动,然后找出和这些事件发生时间点相关的功能磁共振活动。同步EEG-fMRI最早用于探讨发作间期痫样放电(inter-ictal epileptiform discharges, IEDs)相关的功能磁共振信号变化,确定癫痫波的起源和传导进程[26]。IEDs出现时间是随机的,可以用EEG中读出的发生时间来构造回归项。而在睡眠神经影像研究中,纺锤波的定位也采用了类似的思路。睡眠纺锤波主要参与睡眠依赖性记忆巩固和新旧知识整合[27,28],是N2期的特征波形。使用同步EEG-fMRI获取被试的睡眠数据,对EEG数据进行上文所述的核磁伪迹去噪后,需要对完整的EEG数据进行从NREM的N1期到N3期和REM期的分期,再从N2期中识别出纺锤波,最后寻找和纺锤波活动有关的功能磁共振信号[29]。
4.3 获得节律的动态变化
EEG信号包含有丰富的时间和频谱特征,对EEG数据进行时频分解,可以分离出典型的频段或节律,包括δ(2~4 Hz)、θ(4~8 Hz)、α(8~13 Hz)、β(13~30 Hz)、γ(30~40 Hz),可以探讨与这些频段频谱能量共变的功能磁共振活动。首先需要计算出EEG每个电极上各频段的平均功率时间序列,然后将这些时间序列和血液动力学响应函数(hemodynamic response function, HRF)卷积,并对卷积后的时间序列进行降采样和标准化,最后对卷积后各频段的平均功率时间序列和每个体素的功能磁共振信号进行回归分析,从而探讨各频段对应脑区活动。研究者最先关注的是α节律,Goldman等希望借由同步EEG-fMRI研究产生α节律的核心脑区,结果发现α节律的增强会伴随着枕叶、额下回、颞上回和扣带回脑区的负激活和脑岛、丘脑的正激活[30]。通过将多个频段的EEG功率作为fMRI数据广义线性模型分析中的回归项,也可以探讨这些频段对功能磁共振信号的贡献,以及信号之间的交互作用[31-32]。除了特定频段的EEG功率外,频谱的其他特征也可以用于解释功能磁共振信号,比如总功率[33]、频段特定功率值的线性组合[34]、平均频率[35]、根均方频率[36-37]等。
探究EEG节律与fMRI大尺度脑网络的关系,也是当前研究者关注的热点之一。Jann等基于全脑域同步(global field synchronization, GFS)测量获取全脑域上特定频段所有电极的相位锁定活动,然后探讨α节律的GFS和静息态脑网络的关系,结果发现α节律相位锁定成分和DMN的激活有关[37]。Mantini等进一步将分析推广到5个典型节律(δ、θ、α、β、γ)和6个静息态网络,发现一个静息态脑网络与多个节律存在相关,比如DMN和α、β节律正相关,视觉网络则和δ、θ、α、β节律相关,表明不同频段的神经振荡共同作用于同一功能系统[31]。近年来也有大量研究开始关注EEG节律和远距离静息态网络间功能连接的统计相关性。Lei等采用同步EEG-fMRI研究了乙醇的摄入对EEG节律和静息态脑网络功能连接的影响,结果发现饮酒会提高θ节律的能量,并且和默认模式网络-背侧注意网络反相关的提高具有相关性[38],提示脑的慢波节律可能反映了静息态网络间功能交互的动态改变。关于fMRI功能连接的更多电生理机制研究可以参考Schölvinck等的综述[39]。
4.4 提取单试次事件相关电位
ERP是人脑对刺激进行认知加工时的诱发电位。信噪比过低是单试次分析面临的主要挑战。对于一些微弱脑电波,特别是早期ERP成分,很难在单试次中提取到稳定的幅度信息。目前,借助于特征提取、模式识别和机器学习等技术,在微弱信号提取方面已有长足进步。例如,采用ICA方法可将多个电极上测量的微弱事件相关电位,提取为明确的独立成分;基于稀疏表示和外输入自回归模型算法,能在信噪比较低的情况下提取潜伏期和幅值[40]。在进一步整合试次信息后,可构成单试次幅度图。通过观察单试次幅度图电位强度的时间延迟信息,找到认知加工相关的ERP成分,如N170、P300等。从单试次EEG数据中提取到的一些特征,比如ERP成分的幅度、潜伏期、空间拓扑分布等,均可用来进一步探讨电生理特征和功能磁共振信号活动的关系[41- 43]。进一步采用模式识别,可将机器学习识别到的、具有任务分辨性的特征[44- 45]也作为单次实验的量化指标。将从EEG中得到的刺激出现时间和fMRI的序列扫描时间对齐,就可以按照单次实验的幅度得到“单次实验量化曲线”,构建设计矩阵,生成统计参数图。
5 同步EEG-fMRI的应用
目前,同步EEG-fMRI主要应用于探讨癫痫放电的起源和传导过程、大脑自发节律和自发活动相关fMRI活动、各睡眠阶段及一些特殊睡眠脑电波相关的大脑活动、不同认知过程的脑机制等方面,下面我们将分别对同步EEG-fMRI在四个领域的应用进行简单介绍。
5.1 癫痫
虽然已发展出多种致痫灶定位策略,但目前,精准定位仍是神经外科急需解决的难题。尽管皮层脑电在神经外科手术中应用广泛,但它毕竟是一种有创技术,需要对患者开颅。而作为一种无创神经影像技术,同步EEG-fMRI能识别发作间期痫样放电相关的功能磁共振信号,从而确定癫痫放电的起源和传导进程。EEG-fMRI同步采集技术能提供有效的致痫灶定位策略,通常情况下,这些功能磁共振信号改变与痫样放电区域具有高度的一致性,能有效辅助病灶的定位。
在空间对应关系方面,基于发作间期痫样放电的源定位和基于功能磁共振的激活分析在空间上高度重合,但有一定区别。在产生棘波的刺激癫痫灶脑区,神经活动、血氧动力学响应和血液灌注的一致性较高。但当出现痫样放电时,这种一致性关系就不复存在了。在时间对应关系方面,脑解剖的损伤会影响神经和血管的耦合关系。因此当涉及具有畸变、血管瘤或血管损伤的病人时,需要注意由于血氧动力学响应的畸变而导致的功能磁共振激活上的变异。血氧动力学响应反应了痫样放电和功能磁共振响应波形的变化形式,Gotman等通过对大量同步数据的分析发现[46],这种响应具有个体差异,而且同一个体在不同状态下血氧动力学响应的波形也不相同。对血氧动力学响应变异性进行充分考虑,一方面有利于提升同步技术定位病灶的精度,同时也有利于深入探讨不同癫痫亚型的病理机制。
5.2 大脑自发节律和自发活动
研究静息状态下脑内的自发活动,可以促进我们对静息态心理活动的认识,加深对任务态大脑活动的理解。发挥多模态成像的高时空分辨率优势,将EEG的生理特征和同步fMRI信息结合起来,可以获得对功能磁共振信号电生理意义更好的解释。以脑电静息态为切入点研究fMRI的策略主要有两种:(1)基于节律的动态分析方法,研究静息态下不同频段的EEG节律,主要关注其空间分布、谱分布、峰值位置等信息;(2)基于微状态的分析,主要关注其持续时间、幅度等特征。在基于节律的动态分析方面,研究者最初关注的是α节律,探讨α节律相关的核心脑区[30],随后有研究者进一步将视角拓展到各频段节律和大尺度脑网络的关系[31],比如Jann等研究了α节律和DMN的关系[37],Mantini等研究了5个典型节律(δ、θ、α、β、γ)和6个静息态网络的关系[31],θ节律和DMN-DAN反相关的关系[39]。
在基于微状态的分析方面,同步EEG-fMRI的引入,使得研究典型的微状态相关的功能磁共振活动成为可能。Britz等研究发现,在毫秒量级出现的微状态和秒尺度上fMRI的多个静息态网络对应[47]。这些微状态的波形和HRF函数卷积后,和多个区域的功能磁共振活动有关,且这些区域与静息态脑网络具有相似的空间分布模式。微状态反映的是全脑电位分布的变化,为了保持系统的稳定性,Van De Ville等假设这些“思维的原子”应该具有时间上的尺度不变性的特征[48],即不管选择怎样的时间尺度,EEG微状态的变化都具有自相似性。他们对比慢速改变的静息态fMRI和快速改变的EEG微状态,发现虽然EEG微状态卷积上HRF后丢失了大量时间信息,但并没有影响到原始微状态序列携带的尺度不变性。因此,fMRI作为神经活动分布的全脑测量,可能只是这些微状态更大尺度的表现形式,这进一步支持了EEG微状态是全脑认知处理的基本单元这一假说[48]。
神经振荡和血氧动力学是大脑自发神经活动的不同方面,二者之间并无直接的联系:同一特定分布的功能磁共振活动可能对应不同的EEG特征,同一大脑振荡也可能和不同的fMRI活动有关。头表EEG信号和功能磁共振活动产生方式的不同体现了不同的时空特性,这是产生两个模态间不同匹配关系的根源。“静息态”本身就暗示了不活跃性,但可以通过同步EEG-fMRI观察到动态的内源性神经振荡,在静息状态下特定属性的神经网络结构是稳健存在的、可以观察的,未来的研究需要寻找一些具有普遍性、可重复性的电生理-血氧代谢结构。
5.3 睡眠
EEG特征是进行睡眠时相划分的“金标准”。在fMRI中同时记录到的EEG数据可以用来区分不同的睡眠时相,进而能够探究睡眠进程中血氧代谢活动的动态变化过程。Lovblad等于1999年首先采用同步EEG-fMRI技术揭示解释睡眠之谜[49],发现额叶区域的功能磁共振信号在REM期为负激活,而枕叶区域则为正激活。之后有研究对比了清醒和不同睡眠阶段的功能磁共振信号变化,揭示了各个阶段大脑的活动情况[23,25]。这些早期探索性的研究,为开展睡眠的同步EEG-fMRI研究奠定了良好的理论和实践基础。近期的研究视角更为细腻,探讨了睡眠特异性EEG波形,如睡眠纺锤波、K复合波等,充分利用了同步EEG-fMRI高时空分辨的优点[50-51]。睡眠状态下,大脑仍进行着刺激编码加工和记忆巩固,在睡眠过程中对记忆巩固过程进行干预也是目前的研究热点之一[52-53]。这些研究多选择在慢波睡眠阶段播放或释放与清醒期学习材料伴随出现的声音或气味,通过诱发记忆的重激活以达到陈述性记忆巩固、消除恐惧记忆和内隐社会偏见等目的[52-54]。同步EEG-fMRI技术的应用可以研究重激活过程的血氧代谢活动,睡眠时相的识别则需通过实时去噪技术实现。
当然,在睡眠过程中进行同步EEG-fMRI的数据采集也面临着大量的技术挑战。如需要采用核磁兼容的PSG设备,若采用传统的核磁兼容电极帽,则需要增加下颏肌电等电极以及更长的电缆布线;MRI扫描仪运转时间过长会降低成像质量;磁共振的噪声环境和强制头部固定等不利于被试入睡且入睡后容易惊醒;REM睡眠对噪声特别敏感,导致很难获得该阶段的数据。这些困难可以通过增加适应性睡眠,提高被试在嘈杂环境中的入睡率;或者采用恒定噪声法,在磁共振扫描的间隔重复播放扫描噪声,保证扫描间隔具有相同的背景噪声来解决[55]。
5.4 认知功能
同步EEG-fMRI为研究认知加工过程中大脑的功能磁共振响应提供了前所未有的高时空信息,其最有前景的应用领域可能就是认知、决策等脑的高级功能。多年来人脑高级功能的电生理研究为这些实验范式在fMRI成像中的应用奠定了基础,ERP的一些经典成分可以借鉴到事件相关设计的认知实验中,如MMN、N2、ERN等。Iannaccone等就采用同步EEG-fMRI技术结合Flanker范式,探讨了冲突监控和错误加工相关脑活动的区别[56]。他们发现反应错误加工的ERN成分的幅值大小与前扣带回、扣带回喙部和辅助运动区前部激活程度相关,而反应冲突监控的N2成分的幅值大小则与辅助运动区前部的激活程度相关,这表明冲突监控和错误加工两种过程涉及的脑区可能是部分分离的。
同步EEG-fMRI能克服分别采集EEG和fMRI数据时被试的心理过程会发生改变的难题,避免被试的情绪、警觉性以及对实验任务的熟悉度等因素的影响。在学习和记忆实验中,保证相同的实验环境、刺激条件、被试状态、觉醒水平尤为重要。比如,得益于同步EEG-fMRI技术的使用,研究者能在完全相同的实验条件下,探究基于意识的再认和基于熟悉性的判断两种记忆提取机制的区别。Hoppstädter等发现右侧DLPFC和右侧顶内沟的活动与反应熟悉性判断的FN400波幅相关,而右侧海马、旁海马回及压后皮质(retrosplenial cortex)的活动与反应有意识再认的顶区成分幅值相关[57]。这与基于颅内电极记录的结果相一致,表明海马在有意识再认中的作用。
EEG可以在fMRI精确定位的基础上,分离出认知加工的各个过程,如刺激的编码和评估,行为的选择和决策等。许多高级认知功能既有注意等非特异加工过程,也有编码等特异化加工过程,同步EEG-fMRI是进行相关探讨的重要手段。然而,分析EEG特征的指标有很多种,不同指标之间的差异很大,指标选取的差异会影响fMRI分析的结果。Guo等采用同步EEG-fMRI记录了情绪决策任务中大脑的活动,并提取了三种EEG特征(FRN的幅值、α频段的能量和θ频段的能量)作为BOLD信号预测的回归项[58]。他们发现,以不同EEG特征作为回归项得到的大脑激活空间分布和激活强度存在差异。因此,如何根据研究的目的选择合适分析指标,是同步EEG-fMRI应用于认知功能领域面临的挑战之一。
6 未来研究前景
为认识脑的基本原理,探索认知活动的神经机制,阐明神经或精神类疾病的病理机制,必需充分把握脑活动的定位信息和动态信息。同步EEG-fMRI有着广阔的应用前景,近十年来更是飞快发展,论文数量持续增长,应用范围不断扩展。
虽然同步EEG-fMRI的优势十分明显,但是,两者的结合也存在诸多技术难点。由于数据是多模态而且是同时收集的,因此信号会相互干扰,且部分伪迹难以去除。在伪迹去除的算法方面,平均伪迹相减法已经取得了一些成功[59- 60],基于盲源分析的ICA也有应用[61],但如何进一步结合模式识别,深度学习等技术,开发更优的伪迹去除方法仍是亟待解决的技术难题。在硬件方面,目前尚无成熟的伪迹去除硬件系统,许多参数,如锁套的数量、分布尚无定论。未来的研究需要结合算法和硬件两条路线,进一步提高伪迹的去除效果。此外,由于同步EEG-fMRI的实验设计限制太多、分析技术复杂多样,不恰当的使用同步EEG-fMRI,甚至比使用单个模态更加糟糕。目前,同步EEG-fMRI主要广泛应用于癫痫和睡眠的领域。这是因为在癫痫研究中,同步EEG-fMRI能够无创、精准的定位致痫灶;而在睡眠研究中,睡眠分期必须依靠同步采集的EEG信号,这就使得同步EEG-fMRI技术在这两个领域中具有不可替代性。不同的技术适用的科学问题也不尽相同,在未来的研究中,研究者需根据自己的研究问题,充分发挥同步EEG-fMRI的优势,选择合适的分析方法,解决关注的科学问题。
随着硬件设施的完善和软件方法的创新,同步EEG-fMRI正和其他技术一道,丰富了研究者的工具包。未来比较有代表性的研究方向包括:(1)同步EEG-fMRI结合脑刺激技术。经颅磁刺激和经颅直流电刺激技术是目前应用最为广泛的无创脑部干预技术之一,能够通过对大脑特定部位的刺激提高大脑皮层的兴奋性,影响脑内代谢和神经电活动。将同步EEG-fMRI和经颅电/磁刺激等技术结合起来,能够为干预效果提供电生理和代谢两方面的证据。Bharath等就采用了同步EEG-fMRI技术,研究了重复性经颅磁刺激对书写痉挛病人大脑功能连接的改变,结果发现刺激之后病人在EEG和fMRI两个模态上都表现为聚类系数和小世界网络属性的增强[62]。Ladenbauer等采用经颅电刺激在轻度认知障碍患者的N2睡眠期进行0.75 Hz的电刺激。他们发现,电刺激能促进慢波和纺锤波的产生,从而增强患者的记忆巩固[63]。(2)实时伪迹去除。目前多数同步EEG-fMRI研究采用离线处理技术探讨相关的神经机制,但很多研究的展开亟需在线去除核磁诱发伪迹。比如采用同步EEG-fMRI技术探讨睡眠阶段发生的记忆重激活过程,需要在慢波睡眠期通过声音、气味等刺激激活清醒期间获得的记忆,这就需要能够在同步采集时能看到清晰的慢波才能进行睡眠分期判读。参考层自适应滤波[64]、碳纤维索套伪迹矫正[65]等实时伪迹去除技术为这些研究的开展奠定了基础。(3)多模态神经反馈。基于EEG信号的神经反馈已经有数十年历史,积累了大量经验,但干预效果相关的脑机制尚不明晰。Zich等在实时去噪的基础上,通过EEG神经反馈进行中风患者的运动想象训练,并同步采集fMRI,探讨基于运动想象的神经反馈和感觉运动皮层激活的关系[66]。基于两个模态的人机交互形成闭合环路,并用fMRI进行干预效果的评价,有助于推动相关疾病的康复训练和效果跟踪。
7 结论
同步EEG-fMRI以其精准、快速、无创等优势,为探讨心理活动的神经机制提供了强有力的手段。但目前,该技术仍存在信噪比过低,受试者舒适性差和数据融合困难等问题。本文首先介绍了同步EEG-fMRI硬件系统的构成。接着对EEG伪迹的去除方法进行了系统的梳理,重点讨论了梯度伪迹和心电伪迹的去除方法。平均伪迹相减法和独立成分分析是去除这两类伪迹的常用方法,但仍不断有其他算法和硬件创新涌现,推动当前伪迹去除技术的发展。尽管如此,目前仍无法获得干净的EEG信号,亟需发展更强有力的EEG伪迹去除方法,成熟的算法结合优化的硬件,或许是更好的选择。随后,本文根据研究者基于EEG信号的不同指标与fMRI数据进行融合的目的,将现有的研究归纳为区分大脑状态、识别自发电生理事件、获得节律的动态变化、提取单试次事件相关电位四类,着重介绍了如何根据不同的研究目的,提取EEG数据中的不同指标,并建立了一个由简到繁的分析框架。通过回顾同步EEG-fMRI的主要应用领域,本文讨论了同步EEG-fMRI技术在致痫灶定位、识别不同的睡眠时相、分离不同认知加工过程等方面的优越性,也指出了在这些领域应用也存在诸多挑战。同步EEG-fMRI结合脑刺激技术、实时伪迹去除、多模态神经反馈等是该领域未来重要的研究方向,我们相信,同步EEG-fMRI定将在即将启动的中国脑计划研究工作中,发挥其重要的作用。
[1] Lemieux L, Allen P J, Franconi F, et al. Recording of EEG during fMRI experiments: Patient safety[J]. Magnetic Resonance in Medicine, 1997, 38(6):943-952.
[2] Baumann S B, Noll D C. A modified electrode cap for EEG recordings in MRI scanners[J].Clinical Neurophysiology, 1999, 110(12):2189-2193.
[3] Bénar C G, Aghakhani Y, Wang Y, et al. Quality of EEG in simultaneous EEG-fMRI for epilepsy[J]. Clinical Neurophysiology, 2003, 114(3):569-580.
[4] Mullinger K, Debener S, Coxon R, et al. Effects of simultaneous EEG recording on MRI data quality at 1.5, 3 and 7 tesla[J]. International Journal of Psychophysiology, 2008, 67(3):178-188.
[5] 雷旭, 尧德中. 同步脑电-功能磁共振 (EEG-fMRI) 原理与技术[M]. 北京:科学出版社, 2014:29-33.
Lei Xu,Yao Dezhong.Principles and techniques of simultaneous EEG-fMRI[M]. Beijing:Science Press, 2014:29-33.(in Chinese)
[6] Allen P J, Josephs O, Turner R. A method for removing imaging artifact from continuous EEG recorded during functional MRI[J]. Neuroimage, 2000, 12(2):230-239.
[7] Niazy R K, Beckmann C F, Iannetti G D, et al. Removal of FMRI environment artifacts from EEG data using optimal basis sets[J]. Neuroimage, 2005, 28(3):720-737.
[8] Grouiller F, Vercueil L, Krainik A, et al. A comparative study of different artefact removal algorithms for EEG signals acquired during functional MRI[J]. Neuroimage, 2007, 38(1):124-137.
[9] Acharjee P P, Phlypo R, Wu L, et al. Independent Vector Analysis for Gradient Artifact Removal in Concurrent EEG-fMRI Data[J]. IEEE Transactions on Biomedical Engineering, 2015, 62(7):1750-1758.
[10] Chowdhury M E, Mullinger K J, Glover P, et al. Reference layer artefact subtraction (RLAS): a novel method of minimizing EEG artefacts during simultaneous fMRI[J]. Neuroimage, 2014, 84(1):307-319.
[11] Mullinger K J, Yan W X, Bowtell R. Reducing the Gradient Artefact in Simultaneous EEG-fMRI by Adjusting the Subject's Axial Position[J]. Neuroimage, 2011, 54(3):1942-1950.
[12] Allen P J, Polizzi G, Krakow K, et al. Identification of EEG Events in the MR Scanner: The Problem of Pulse Artifact and a Method for Its Subtraction[J]. Neuroimage, 1998, 8(3):229-239.
[13] Vanderperren K, Vos M D, Ramautar J R, et al. Removal of BCG artifacts from EEG recordings inside the MR scanner: A comparison of methodological and validation-related aspects[J]. Neuroimage, 2010, 50(3):920-934.
[14] Bonmassar G, Purdon P L, Jääskeläinen I P, et al. Motion and ballistocardiogram artifact removal for interleaved recording of EEG and EPs during MRI[J]. Neuroimage, 2002, 16(4):1127-1141.
[15] Masterton R A, Abbott D F, Fleming S W, et al. Measurement and reduction of motion and ballistocardiogram artefacts from simultaneous EEG and fMRI recordings[J]. Neuroimage, 2007, 37(1):202-211.
[16] Xia Hongjing, Dan Ruan, Cohen M S. Removing ballistocardiogram (BCG) artifact from full-scalp EEG acquired inside the MR scanner with Orthogonal Matching Pursuit (OMP)[J]. Frontiers in Neuroscience, 2014, 8(8):218-230.
[17] Krishnaswamy P, Bonmassar G, Poulsen C, et al. Reference-free removal of EEG-fMRI ballistocardiogram artifacts with harmonic regression[J]. Neuroimage, 2016, 128:398- 412.
[18] Lei Xu, Xu Peng, Luo Cheng, et al. fMRI functional networks for EEG source imaging[J]. Human Brain Mapping, 2011, 32(7):1141-1160.
[19] Lei Xu, Hu Jiehui, Yao Dezhong. Incorporating fMRI Functional Networks in EEG Source Imaging: A Bayesian Model Comparison Approach[J]. Brain Topography, 2012, 25(1):27-38.
[20] Lei Xu, Wu Taoyu, Valdes-Sosa P A. Incorporating priors for EEG source imaging and connectivity analysis[J]. Frontiers in Neuroscience, 2015, 9(16):284-296.
[21] Lange N, Zeger S L. Non-linear Fourier Time Series Analysis for Human Brain Mapping by Functional Magnetic Resonance Imaging[J]. Journal of the Royal Statistical Society, 1997, 46(1):1-29.
[22] Kaufmann C, Wehrle R, Wetter T C, et al. Brain activation and hypothalamic functional connectivity during human non-rapid eye movement sleep: an EEG/fMRI study[J]. Brain, 2006, 129(3):655- 667.
[23] Horovitz S G, Braun A R, Carr W S, et al. Decoupling of the Brain's Default Mode Network during Deep Sleep[J]. Proc Natl Acad Sci U S A, 2009, 106(27):11376-11381.
[24] Lei Xu, Wang Yulin, Yuan Hong, et al. Brain Scale-free Properties in Awake Rest and NREM Sleep: A Simultaneous EEG/fMRI Study[J]. Brain Topography, 2015, 28(2):292-304.
[25] Taira U, Takao Y, Tsuyoshi O, et al. Efficiency of a "small-world" brain network depends on consciousness level: a resting-state FMRI study[J]. Cerebral Cortex, 2014, 24(6):1529-1539.
[26] Gotman J, Kobayashi E, Bagshaw A P, et al. Combining EEG and fMRI: a multimodal tool for epilepsy research[J]. Journal of Magnetic Resonance Imaging, 2006, 23(6):906-920.
[27] 贵文君, 雷旭, 袁宏,等. 老化对睡眠依赖性记忆巩固的影响[J]. 心理科学进展, 2015, 23(9):1568-1578. Gui Wenjun, Lei Xu, Yuan Hong, et al. Sleep-dependent Memory Consolidation: The Effect of Aging[J]. Advances in Psychological Science,2015, 23(9):1568-1578.(in Chinese)
[28] 雷旭, 赵文瑞. 睡眠影响记忆巩固的同步EEG-fMRI研究[J]. 心理科学进展, 2016, 24(3):327-334.
Lei Xu, Zhao Wenrui. Simultaneous EEG-fMRI studies of sleep-dependent memory consolidation[J]. Advances in Psychological Science, 2016, 24(3):327-334.(in Chinese)
[29] Schabus M, Dang-Vu T T, Albouy G, et al. Hemodynamic Cerebral Correlates of Sleep Spindles during Human Non-Rapid Eye Movement Sleep[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(32):13164-13169.
[30] Goldman R I, Stern J M, Jr E J, et al. Simultaneous EEG and fMRI of the alpha rhythm[J]. Neuroreport, 2002, 13(18):2487-2492.
[31] Mantini D, Perrucci M G, Gratta C D, et al. Electrophysiological signatures of resting state networks in the human brain[J]. Proc Natl Acad Sci U S A, 2007, 104(32):13170-13175.
[32] De Munck J C, Gonçalves S I, Mammoliti R, et al. Interactions between different EEG frequency bands and their effect on alpha-fMRI correlations[J]. Neuroimage, 2009, 47(1):69-76.
[33] Wan Xiaohong, Riera J, Iwata K, et al. The neural basis of the hemodynamic response nonlinearity in human primary visual cortex: Implications for neurovascular coupling mechanism[J]. Neuroimage, 2006, 32(2):616- 625.
[34] Goense J B, Logothetis N K. Neurophysiology of the BOLD fMRI signal in awake monkeys[J]. Current Biology, 2008, 18(9):631- 640.
[35] Rosa M J, Kilner J, Blankenburg F, et al. Estimating the transfer function from neuronal activity to BOLD using simultaneous EEG-fMRI[J]. Neuroimage, 2010, 49(2):1496-1509.
[36] Kilner J M, Mattout J, Henson R, et al. Hemodynamic correlates of EEG: A heuristic[J]. Neuroimage, 2005, 28(1):280-286.
[37] Jann K, Dierks T, Boesch C, et al. BOLD correlates of EEG alpha phase-locking and the fMRI default mode network[J]. Neuroimage, 2009, 45(3):903-916.
[38] Lei Xu, Wang Yulin, Yuan Hong, et al. Neuronal oscillations and functional interactions between resting state networks[J]. Human Brain Mapping, 2014, 35(7):3517-3528.
[39] Schölvinck ML, Leopold DA, Brookes MJ, et al. The contribution of electrophysiology to functional connectivity mapping[J]. Neuroimage, 2013, 80(20):297-306.
[40] 余南南, 吴玲玲, 陈莹. 基于稀疏表示和外输入自回归模型的单次诱发电位提取方法[J]. 信号处理, 2017,33(3A):16-21.
Yu Nannan, Wu Lingling, Chen Ying. Single-trial Evoked Potentials Extraction with Sparse representation and ARX[J]. Journal of Signal Processing,2017,33(3A):16-21. (in Chinese)
[41] Eichele T, Specht K, Moosmann M, et al. Assessing the spatiotemporal evolution of neuronal activation with single-trial event-related potentials and functional MRI[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(49):17798-17803.
[42] Nguyen V T, Cunnington R. The superior temporal sulcus and the N170 during face processing: Single trial analysis of concurrent EEG-fMRI[J]. Neuroimage, 2014, 86(2):492-502.
[43] Bénar C G, Schön D, Grimault S, et al. Single-trial analysis of oddball event-related potentials in simultaneous EEG-fMRI[J]. Human Brain Mapping, 2007, 28(7):602- 613.
[44] Goldman R I, Wei C Y, Philiastides M G, et al. Single-trial discrimination for integrating simultaneous EEG and fMRI: Identifying cortical areas contributing to trial-to-trial variability in the auditory oddball task[J]. Neuroimage, 2009, 47(1):136-147.
[45] Lei Xu, Yang Ping, Yao Dezhong. An empirical bayesian framework for brain-computer interfaces[J]. IEEE Transactions on Neural Systems & Rehabilitation Engineering A Publication of the IEEE Engineering in Medicine & Biology Society, 2009, 17(6):521-529.
[46] Bénar C G, Gross D W, Wang Y, et al. The BOLD response to interictal epileptiform discharges[J]. Neuroimage, 2002, 17(3):1182-1192.
[47] Britz J, Van de Ville D, Michel C M. BOLD correlates of EEG topography reveal rapid resting-state network dynamics[J]. Neuroimage, 2010, 52(4):1162-1170.
[48] Van de Ville D, Britz J, Michel C M. EEG microstate sequences in healthy humans at rest reveal scale-free dynamics[J]. Proc Natl Acad Sci U S A, 2010, 107(42):18179-18184.
[49] Lövblad K O, Thomas R, Jakob P M, et al. Silent functional magnetic resonance imaging demonstrates focal activation in rapid eye movement sleep[J]. Neurology, 1999, 53(9):2193-2195.
[50] Tamminen J, Payne J D, Stickgold R, et al. Sleep spindle activity is associated with the integration of new memories and existing knowledge[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2010, 30(43):14356-14360.
[51] Jahnke K, Von W F, Morzelewski A, et al. To wake or not to wake? The two-sided nature of the human K-complex[J]. Neuroimage, 2012, 59(2):1631-1638.
[52] Rasch B, Büchel C, Gais S, et al. Odor cues during slow-wave sleep prompt declarative memory consolidation[J]. Science, 2007, 315(5817):1426-1429.
[53] Hu Xiaoqing, Antony J W, Creery J D, et al. Unlearning Implicit Social Biases During Sleep[J]. Science, 2015, 348(6238):1013-1015.
[54] He Jia, Sun Hongqiang, Li Suxia, et al. Effect of conditioned stimulus exposure during slow-wave sleep on fear memory extinction in humans[J]. Sleep, 2015, 38(3):423- 431.
[55] 雷旭, 刘欢, 李红. 睡眠的同步EEG-fMRI研究述评[J]. 心理科学进展, 2013, 21(3):448- 457.
Lei Xu, Liu Huan, Li Hong. A Survey of Simultaneous EEG-fMRI on Sleep[J]. Advances in Psychological Science, 2013, 21(3):448- 457.(in Chinese)
[56] Iannaccone R, Hauser T U, Staempfli P, et al. Conflict monitoring and error processing: New insights from simultaneous EEG-fMRI[J]. Neuroimage, 2015, 105:395- 407.
[57] Hoppstadter M, Baeuchl C, Diener C, et al. Simultaneous EEG-fMRI reveals brain networks underlying recognition memory ERP old/new effects[J]. Neuroimage, 2015, 116:112-122.
[58] Guo Qian, Zhou Tiantong, Li Wenjie, et al. Single-trial EEG-informed fMRI analysis of emotional decision problems in hot executive function[J]. Brain & Behavior, 2017, 7(7):728-737.
[59] Green J J, Boehler C N, Roberts K C, et al. Cortical and subcortical coordination of visual spatial attention revealed by simultaneous EEG-fMRI recording[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2017, 37(33):7803-7810.
[60] Steyrl D, Krausz G, Koscjitnig K, et al. Online reduction of artifacts in EEG of Simultaneous EEG-fMRI using Reference Layer Adaptive Filtering (RLAF)[J]. Brain Topogr, 2018, 31: 129-149.
[61] Wang Kai, Li Wenjie, Dong Li. Clustering-Constrained ICA for Ballistocardiogram Artifacts Removal in Simultaneous EEG-fMRI[J]. Frontiers in Neuroscience, 2018, 12:13-26.
[62] Bharath R D, Panda R, Reddam V R, et al. A Single Session of rTMS Enhances Small-Worldness in Writer’s Cramp: Evidence from Simultaneous EEG-fMRI Multi-Modal Brain Graph[J]. Frontiers in Human Neuroscience, 2017, 11(11):443- 454.
[63] Ladenbauer J, Ladenbauer J, Külzow N, et al. Promoting sleep oscillations and their functional coupling by transcranial stimulation enhances memory consolidation in mild cognitive impairment[J].Journal of Neuroscience, 2017, 37(30): 7111-7124.
[64] Steyrl D, Krausz G, Koschutnig K, et al. Reference layer adaptive filtering (RLAF) for EEG artifact reduction in simultaneous EEG-fMRI[J]. Journal of Neural Engineering, 2017, 14(2):3-27.
[65] Van der Meer JN, Pampel A, Someren E J W V, et al. Carbon-wire loop based artifact correction outperforms post-processing EEG/fMRI corrections—A validation of a real-time simultaneous EEG/fMRI correction method[J]. Neuroimage, 2016, 125:880- 894.
[66] Zich C, Debener S, Kranczioch C, et al. Real-time EEG feedback during simultaneous EEG-fMRI identifies the cortical signature of motor imagery[J]. Neuroimage, 2015, 114:438- 447.


